Проект РНФ «Сравнение циркулирующих и тканерезидентных В-клеток памяти при формировании долговременного иммунитета».
Руководитель: М.Г. Бязрова
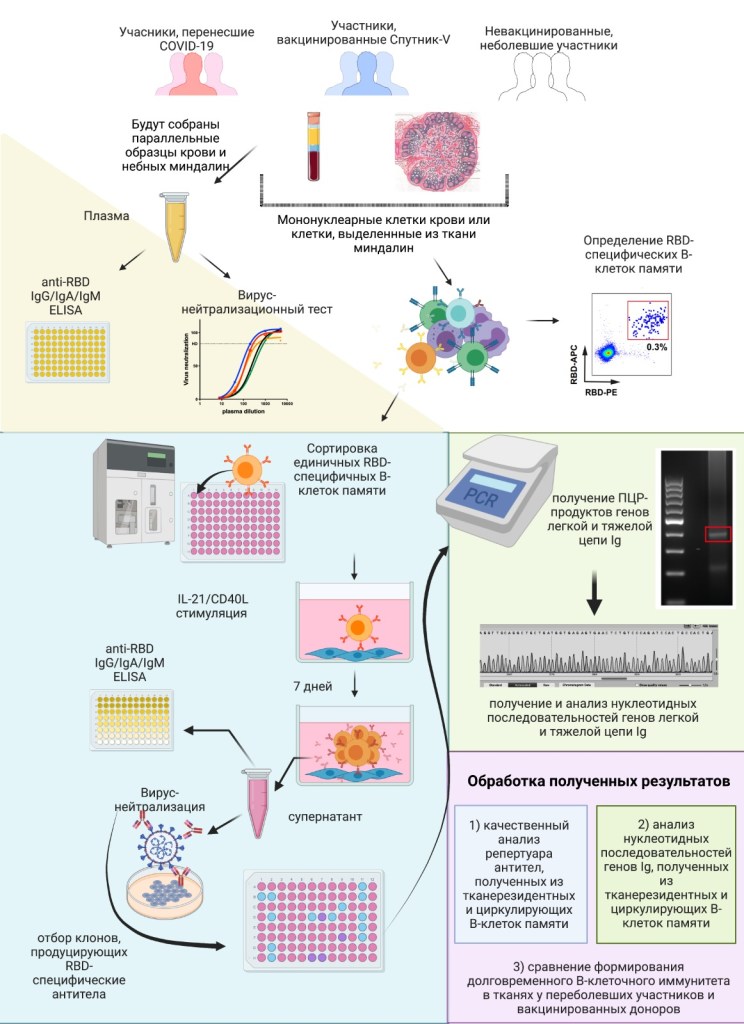
Адаптивный иммунитет условно можно подразделить на три ветви: Т-клеточный иммунитет, В-клеточный иммунитет и гуморальный иммунитет, представленный антителами. Антительный иммунитет формируется в следствии активации, пролиферации и дифференцировки В-лимфоцитов, что подчеркивает важность изучения в первую очередь В-клеточного звена. Общий пул лимфоцитов можно условно поделить на тех, которые циркулируют в крови и тех, которые являются тканерезидентными. Из-за труднодоступности тканерезидентных лимфоцитов, на данный момент основные исследования по изучению долговременной клеточной памяти были выполнены только с учетов циркулирующих в крови лимфоцитов. Таким образом до сих пор остается неизвестным насколько правомерно экстраполировать результаты, полученные для В-лимфоцитов крови человека, на всю иммунную систему. Пандемия SARS-CoV-2 и последующая активная вакцинация российской вакциной Спутник-V предоставила удобную возможность для сравнительного изучения тканевого и циркулирующего клеточного иммунитета. В данном исследовании мы планируем сравнить антигенспецифический иммунный ответ циркулирующих и тканерезидентных В-клеток памяти у пациентов переболевших SARS-CoV-2 или вакцинированных Спутник-V. Полученные данные помогут в принятии решений в области персонализированного здравоохранения и политики по борьбе с инфекционными заболеваниями. Актуальность проекта состоит в том, что долговременная В-клеточной память в тканях является мало изученной областью исследований. Понимание процессов формирования долговременного В-клеточной памяти в тканях человека после вакцинации или перенесенных инфекций необходимо для оценки протективного иммунитета. Новизна проекта состоит в том, что впервые будет проведен сравнительный функциональный анализ тканерезидентных и циркулирующих антиген-специфических В-лимфоцитов у доноров переболевших COVID-19 или вакцинированных Спутник-V. На основе полученных результатов можно будет сделать выводы о различиях в формировании долговременной клеточной памяти у пациентов перенесших COVID-19 и добровольцев, вакцинированных Спутник-V. Кроме того, полученные нами результаты можно будет использовать для разработки универсальной платформы по получению человеческих монАТ. Планируется сформировать две когорты доноров, в каждую из которых войдет от 10 до 20 участников. Первая группа будет состоять из пациентов, переболевших COVID-19, вторая из неболевших вакцинированных доноров. У каждого участника исследования будут собраны параллельные образцы крови и небных миндалин. В качестве контроля будут собраны образцы неболевших и невакцинированных добровольцев. Будет проведено сравнение репертуара циркулирующих и тканерезидентных В-клеток памяти. Для этого из параллельных образцов миндалин и крови пациента будут отсортированы RBD+ B-клетки памяти. Путем in vitro стимуляции из единичных клеток будут получены клоны В-лимфоцитов. Супернатанты клонов будут оттестированы на вирус-нейтрализующую способность против Уханьского варианта коронавируса, а также его мутантных вариантов. Данный подход позволит оценить вирус-нейтрализующую активность отдельных В-клеток памяти, что предоставит возможность проанализировать качество долговременной В-клеточной памяти у отдельных пациентов. Планируется провести анализ репертуара антиген-специфических В-лимфоцитов с помощью секвенирования клонов, нейтрализующих SARS-CoV-2 и/или его мутантные варианты. В исследовании будут принимать участие молодые специалисты из двух лабораторий, имеющие опыт работы в области иммунологии, клеточной и молекулярной биологии.
Проект РНФ «Перепрограммирование В-клеток памяти с целью создания продуцентов человеческих терапевтических моноклональных антител».
Руководитель: А.В. Филатов
Термин перепрограммирование обычно применяется для обозначения возврата зрелых специализированных клеток в состояние индуцированных плюрипотентных стволовых клеток. В нашем проекте мы используем этот термин в отношении методов, которые позволяют при культивировании in vitro направлять дифференцировку клеток в желаемом направлении. В-клетки являются важным звеном иммунитета, они отвечают за выработку антител. В своем развитии В-клетки претерпевают сложный путь дифференцировки от незрелой В-клетки до клеток памяти и плазматических клеток. По сравнению с другими типами иммунокомпетентных клеток дифференцировка В-лимфоцитов остается недостаточно изученным процессом, который плохо поддается моделированию и воспроизведению in vitro. Стимуляция В-клеток с помощью интерлейкинов (IL), а также лиганда рецептора CD40 (CD40L) приводит к образованию плазмобластов, которые через короткое время вступают в апоптоз. Для того, чтобы изменить эту траекторию развития и получить стабильно пролиферирующие и секретирующие В-клетки необходимо их перепрограммировать, например путем введения генов BCL-6 и BCL-XL. Принудительная экспрессия транскрипционного фактора BCL-6 будет обеспечивать устойчивую пролиферацию, а белок BCL-XL защищать от апоптоза. Ранее нами были отработаны условия стимуляции В-лимфоцитов in vitro и трансдукции с помощью лентивирусного вектора с последующим культивированием в течении нескольких месяцев (проект РНФ № 19-15-00331). При этом В-клетки сохраняли фенотип плазмобластов, секретировали Ig и пролиферировали. К сожалению, уровень пролиферации оставался низким, что не позволяло проводить клонирование, а также наращивать значительную биомассу, необходимую для биотехнологической наработки препаративных количеств человеческих моноклональных антител. Для того чтобы добиться стабильной пролиферации В-клеток и получить продуценты человеческих моноклональных антител, мы предлагаем оптимизировать процесс перепрограммирования В-клеток по нескольким направлениям. В качестве источника В-лимфоцитов мы будем использовать периферическую кровь или лимфоузлы. В-лимфоциты после иммуномагнитной сепарации и выделения антиген-специфических клеток мы будем стимулировать in vitro в присутствии IL-21 и фидерных леток, несущих CD40L. В качестве альтернативы будет разработана бесфидерная система, где в качестве CD40L будет использоваться (а) рекомбинантный белок CD40L гексамеризованный адипонектиновым доменом; (б) внеклеточные везикулы, несущие CD40L; (в) бактериофаг Т4, декорированный CD40L. Перепрограммирование CD40L/IL-21-симулированных В-лимфоцитов будет осуществляться с помощью трансдукции вирусами, несущими гены BCL-6 и BCL-XL. Для доставки генов в В-клетки памяти мы будем использовать лентивирусы, псевдотипированные различными белками оболочки (VSV-G, RD114, H/F и BaEV). Большое внимание в проекте будет уделено использованию аденоассоциированных вирусов (AAV) для перепрограммирования В-клеток памяти. Мы сравним по эффективности различные серотипы: AAV2, AAV6, AAV-DJ. Для поддержания стабильной экспрессии генов BCL-6 и BCL-XL мы сравним промоторы цитомегаловируса (CMV) и эукариотический промотор EF-1a. Успешность перепрограммирования В-лимфоцитов мы будем оценивать по фенотипу клеток, а также по продукции антител, которые будем определять методом ELISA, ELISpot и вирус-нейтрализации. Решение поставленных задач позволит получать стабильно пролиферирующие линии В-клеток, секретирующих человеческие моноклональные антитела, которые в последующем будут применяться в иммунотерапии. В перспективе перепрограммирование В-клеток может также использоваться для лечения иммунодефицитных заболеваний, связанных с дефектами в развитии и дифференцировки В-лимфоцитов.

Проект РНФ «Анализ долговременной В-клеточной иммунологической памяти после перенесенной инфекции SARS-CoV-2»
Руководитель: А.Г. Прилипов
Для прогнозирования дальнейшего распространения COVID-19 необходимы знания о продолжительности иммунологической памяти к коронавирусным антигенам. Эффективность разрабатываемых вакцин также будет определяться устойчивостью иммунологической памяти против SARS-CoV-2. Приобретенный иммунитет складывается из трех компонентов: гуморальная, а также Т- и В-клеточная память. Все три компонента участвуют в создании и поддержании иммунологической защиты против SARS-CoV-2. Опубликованные данные, в основном касаются гуморальной иммунологической памяти на SARS-CoV-2. Они свидетельствуют о том, что память на уровне антител сохраняется по крайней мере в течении нескольких месяцев. Показано также, что Т-клеточный ответ на SARS-CoV-2 является вполне продуктивным. Наименее изученным остается вопрос об формировании и продолжительности В-клеточной памяти после перенесенной коронавирусной инфекции. В ряде публикаций были описаны В-клетки памяти, которые образуются вскоре после перенесенного COVID-19, однако в этих работах В-клетки памяти использовались исключительно как источник генов Ig для последующего получения терапевтических моноклональных антител. Вопросы формирования, а также продолжительности В-клеточной памяти в этих работах не рассматривались.
Недавно нами было проведено исследование В-клеточного иммунитета в острой фазе SARS-CoV-2 инфекции. В исследование было включено более 100 пациентов с COVID-19. Нами было обнаружено, что В-клетки памяти активно образуются во время острой фазы SARS-CoV-2 инфекции. Было также показано, что В-клетки памяти при стимуляции способны дифференцироваться в антитело-секретирующие клетки, которые продуцируют вирус-связывающие и вирус-нейтрализующие антитела. Насколько нам известно, это первое исследование, в котором выполнено количественное определение SARS-CoV-2 специфических антитело-секретирующих клеток методом ELISpot. Полученные нами данные являются хорошей отправной точкой для изучения долговременной В-клеточной памяти после перенесенной коронавирусной инфекции.
В проекте на протяжении 3 лет будет изучена динамика В-клеток памяти у пациентов, переболевших COVID-19. В первую очередь в исследование будут включены бывшие пациенты, для которых В-клетки памяти уже были определены во время острой фазы COVID-19. Тестирование В-клеток памяти будет осуществляться с помощью разработанного нами метода ELISpot с использованием в качестве антигена рекомбинантного поверхностного Spike белка из вируса SARS-CoV-2. Поскольку В-клетки памяти являются покоящимися лимфоцитами, то для стимуляции продукции антител мы будем активировать В-клетки in vitro в течении 7 дней с помощью агониста толл-подобного рецептора 9 или комбинацией IL-21/CD40L. Параллельно этому мы будем также определять вирус-связывающую и вирус-нейтрализующую активность сывороточных антител. Тестирование вирус-нейтрализующей активности будет проводится с помощью биобезопасной системы на основе лентивируса, псевдотипированного белком S из SARS-CoV-2. Динамику вирус-специфических В-клеток памяти мы сравним с кинетикой гуморальной иммунологической памяти. Антиген-специфические В-клетки памяти мы будем окрашивать коронавирусным Spike белком, коньюгированным с фикоэритрином. Антиген-специфические лимфоциты будут отсортированы и гены Ig будут секвенированы из одиночных клеток. Это позволит нам определить динамику репертуара В-клеточного рецептора. Проект будет осуществляться при тесной кооперации с клиникой ФНКЦ ФМБА, которая сейчас полностью перепрофилирована в инфекционный центр для лечения COVID-19. Полученные данные о В-клеточной иммунологической памяти помогут в построении эпидемиологической модели короновирусной инфекции, а также для ответа на вопрос о возможности реинфекции коронавирусом.
Результаты проекта будут также важны для оценки эффективности разрабатываемых вакцин против SARS-CoV-2.
Проект Минобрнауки «Технологическая платформа экстренного создания средств профилактики и терапии вирусных инфекций на примере SARS-CoV-2-нейтрализующих антител».
Руководитель: А.В. Таранин
На данный момент получены терапевтические антитела ко всем известным штаммам коронавируса, включая «омикрон», и основной задачей является получение универсальных антител, которые будут узнавать все возможные варианты вируса.
В S-белке, который необходим для попадания вируса в клетки человека, постоянно происходят замены, и таким образом вирус ускользает от уничтожения антителами, поэтому главной целью является получение антитела именно к тем участкам S-белка, которые остаются общими у всех вариантов вируса. Можно ожидать, что лекарства, созданные на основе таких антител, смогут успешно предотвратить заражение или тяжелое течение болезни у людей из групп повышенного риска: пожилых, онкобольных, людей с различными иммунодефицитами и т. д.
Проект РНФ «Cоздание антиген-специфических иммортализованных клонов В-лимфоцитов человека, предназначенных для получения терапевтических моноклональных антител».
(проект завершен)
Руководитель: А.В. Филатов
Моноклональные антитела доказали свою эффективность при лечении ряда онкологических и аутоиммунных заболеваний. В настоящее время терапевтические антитела человеческого происхождения получают методом фагового дисплея или с помощью гибридомной технологии с использованием мышей, трансгенных по Ig человека. Однако эти подходы являются либо трудоемкими, либо труднодоступными, что ограничивает спектр генерируемых антител. Проблему быстрого получения терапевтических антител можно решить, если найти эффективный способ иммортализации В-лимфоцитов человека in vitro. Известно, что клоны Т-лимфоцитов человека легко получить в присутствии интерлейкина 2 и антиген-представляющих клеток, нагруженных целевым антигеном. Попытки заставить В-лимфоциты человека пролиферировать в культуре in vitro предпринимались давно, например, с помощью вируса Эпштейн-Барр в сочетании с лигандами толл-подобных рецепторов TLR-7 и TLR-9 (Lanzavecchia 2018). Несмотря на определенные успехи в этом направлении, пролиферативный потенциал В-клеток человека остается ограниченным. Недавно Kwakkenbos с соавт. (2016) продемонстрировал, что интерлейкин 21 (IL21) в сочетании с молекулой CD40L, экспрессированной на поверхности фидерных клеток, индуцирует мощную пролиферацию В-клеток человека. В наших предварительных экспериментах мы обнаружили, что в этих условиях В-клетки активно делятся, секретируют Ig и приобретают фенотип активированных лимфоцитов, но примерно к 10 дню потенциал пролиферации снижается и лимфоциты гибнут путем апоптоза. Можно предположить, что совместное действие стимуляции и анти-апоптотического репрограммирования позволит преодолеть пролиферативный барьер. Для получения оверэкспрессии анти-апоптотических генов BCL-6 и BCL-XL мы будем использовать ленти- и/или ретровирусную доставку. Новизна проекта состоит в том, что в дополнении к известным стимулам IL21 и CD40L мы будем использовать фактор BAFF (B-cell activating factor), который селективно увеличивает выживаемость плазмобластов. Кроме того, мы создадим безфидерную систему активацию В-лимфоцитов. Для этого будет получен рекомбинантный белок CD40L, который через изолейциновый зиппер слит с Fc фрагментом Ig. Это позволит получить молекулу CD40L в гексамерной форме, что необходимо для ее эффективного действия вне фидерных клеток. Химерный CD40L-Fc, сорбированный на пластик, в присутствии растворимого IL21 будет стимулировать В-лимфоциты человека. Отсутствие фидерных клеток позволит упростить процедуру стимуляции и облегчить ранний отбор наиболее аффинных клонов. Таким образом мы сможем совместить стимуляцию с этапом клонирования и тестирования антиген-специфических В-лимфоцитов. Для получения антиген-специфических иммортализованных В-клонов из крови добровольцев, иммунизированных одной из разрешенных вакцин или переболевших инфекционным заболеванием, будут выделены плазмобласты, которые будут стимулированы и репрограммированы, как описано выше. Антигенная специфичность В-клеточных клонов будет охарактеризована в тестах иммуноферментного анализа, Вестерн блота и ELISpot с вакцинным антигеном. Методом высокопроизводительного секвенирования мы сравним репертуары вариабельных генов Ig до и после стимуляции. Это позволит ответить на вопрос о том, сопровождается ли IL21/CD40L стимуляция с процессом гипермутаций в генах Ig. Кроме того, в отобранных В-клеточных клонах методом секвенирования по Сэнгеру будут определены полные ДНК-последовательности сопряженных легких и тяжелых цепей Ig. Используя эти последовательности, можно будет производить антиген-специфические рекомбинантные антитела. В исследовании будут принимать участие три лаборатории, специализирующиеся в области иммунологии, молекулярной биологии и функциональной геномики. Итогом работы будет создание нового метода стимуляции и иммортализации В-лимфоцитов человека, что позволит в будущем легко получать терапевтически пригодные антитела полностью человеческого происхождения.
«Мега Грант» » «От иммунного узнавания мажорного аллергена пыльцы берёзы Bet v 1 к специфическим диагностическим, терапевтическим и превентивным стратегиям для аллергии на пыльцу берёзы»
Руководитель: М.Г. Бязрова (совместно с Р. Валента, Венский Медицинский Университет)
Целью проекта является не только разработка специфического лечения для аллергии на пыльцу берёзы, но и, впервые в мире, заложить фундамент для стратегий профилактики и иммунности для предотвращения развития аллергии в течение школьного возраста.
Проект РНФ «Пути фосфорилирования CD45 ассоциированного протеина (CD45-AP) и его роль в процессах активации лимфоцитов человека».
(проект завершен)
Руководитель: А.В. Филатов
Фосфатаза CD45 контролирует в лимфоцитах уровень фосфорилирования ряда рецепторов и сигнальных молекул и таким образом является важным регулятором процесса активации лимфоцитов. Однако что управляет активностью самого CD45 остается невыясненным до настоящего времени. На роль регулятора может претендовать так называемый «CD45 ассоциированный протеин» (CD45-AP). Этот белок образует надмолекулярный комплекс не только с CD45, но также взаимодействует с корецептором CD4 и киназой Lck. Имеются веские основания полагать, что белок CD45-AP выполняет в клетке какие-то важные, но пока неизвестные функции. Прежде всего, сама ассоциация CD45-AP с CD45, CD4 и Lck очевидно не является случайной, а отражает тесные взаимодействия между этими молекулами. Во-вторых, известно, что белок CD45-AP может фосфорилироваться, а это является указанием на его возможную регуляторную роль белка CD45-AP. В третьих, степень его фосфорилирования зависит от активации клетки. Целью проекта является выяснение функции молекулы CD45-AP.
Протеин CD45-AP не принадлежит ни к одному известному семейству белков и не имеет гомологов. Доменная организация этого белка неизвестна, а функция не определена, поэтому в данном исследовании придется решать абсолютно новые научные задачи.
Проект РНФ «Поиск новых факторов рестрикции ВИЧ-1, ограничивающих репликацию вируса в условиях его межклеточной трансмиссии, путем скрининга библиотеки нокаутов GeCKO».
(проект завершен)
Руководитель: Д.В. Мазуров
Изучение факторов рестрикции ВИЧ важно для понимания эволюции врожденной невосприимчивости к ретровирусам. Известно, что ВИЧ не размножается ни в мышах, ни в обезьянах, что обеспечивается множеством факторов естественной невосприимчивости клеток к вирусу. У человека также включаются механизмы клеточной резистентности к ВИЧ, однако вирус с помощью своих вспомогательных белков эффективно выключает данные механизмы. Тот факт, что ВИЧ на начальных стадиях заражения человека размножается в лимфоузлах, где формируется множество контактов между иммунными клетками, указывает на то, что межклеточная трансмиссия вируса играет первостепенную роль в заражении Т-клеток. В рамках проекта планируется провести поиск и обнаружить новые факторы рестрикции, противодействующие размножению ВИЧ в данных условиях, а также вскрыть механизм их действия на вирус. Это позволит глубже понять патогенез СПИДа на ранних стадиях заражения и выработать новую стратегию усиления естественной резистентности к ВИЧ.
Проект РФФИ «Создание аденовирусного вектора на основе нуклеазы Cas9, гидовой РНК и донорской ДНК для эффективного редактирования генома человека».
(проект завершен)
Руководитель: Д.В. Мазуров
Целью проекта является поиск путей повышения эффективности гомологичной рекомбинации (HR), индуцированной двухспиральным разрывом ДНК. Планируется проверить гипотезу усиления рекомбинации в результате целенаправленной доставки донорской ДНК к месту репарации геномной ДНК. Для этого гидовая РНК будет модифицирована путем присоединения с 5’- или 3’-конца короткой области гомологии с донорской ДНК. Это вероятно будет способствовать образованию комплекса, состоящего из донорской ДНК, гидовой РНК и нуклеазы Cas9 и усилению гомологичной рекомбинации (HR). Кроме того, будет определена оптимальная длина донорсокой ДНК, соответствующая наиболее высокому уровню рекомбинации. Уровень HR будет оцениваться по степени репарации мутированного гена-репортера gfp-turbo, клеточная модель которого будет также создана. Так как наиболее эффективным и безопасным способом доставки генов в первичные клетки человека считаются аденовирусные векторы, то на следующем этапе экспрессионные кассеты с нуклеазой Cas9, модифицированной гидовой РНК и донорской ДНК будут собраны в промежуточном векторе и затем клонированы в конечный вектор Ad5. Полученные с помощью вектора аденовирусные частицы будут тестированы сначала в модельном эксперименте на клеточных линиях с дефектным геном-репортером, а в конечном итоге на стволовых клетках крови пуповины. В случае успешного тестирования метода in vitro его можно будет испытать в клинической практике для эффективной коррекции моногенных заболеваний человека таких например, как гемофилия, тяжелый комбинированный Х-сцепленный иммунодефицит человека и пр.