Каково качество и продолжительность вирус-специфической В-клеточной памяти после перенесённой инфекции SARS-CoV-2?
В декабре 2019 в Китае были зарегистрированы первые случаи заболевания COVID-19. Уже 11 марта 2020 года распространение вируса достигло общемировых масштабов и было признано пандемией.
Известно, что успех в борьбе с данной вирусной инфекцией будет определяться профилактическими мерами, в частности, разработкой вакцин против SARS-CoV-2. На сегодняшний день созданы и выпущены на рынок ряд вакцин против коронавируса — «Спутник V», а также продукты компаний Johnson & Johnson и AstraZeneca. Эффективность вакцины определяется качеством иммунологической памяти к коронавирусным антигенам. На данный момент во всем мире ведутся активные исследования механизмов формирования и способов усиления иммунологической памяти на SARS-CoV-2, опосредованной В-клетками.
С мая 2020 года наша лаборатория занимается изучением долговременной В-клеточной иммунологической памяти после перенесённой инфекции SARS-CoV-2. Наши исследования охватывают процесс формирования В-клеток памяти в острый период заболевания, а также дальнейшую динамику В-клеток памяти у COVID-19-переболевших пациентов. Полученные нами результаты имеют важное значение в прогнозировании дальнейшего распространения SARS-CoV-2, а также в определении рационального плана-графика профилактической вакцинации.
Известно, что ранний В-клеточный ответ обусловлен, по большей части, короткоживущими антителосекретирующими клетками – плазмобластами. Одновременно, другие В-клеточные популяции проходят селекцию в зародышевых центрах вторичных лимфоидных органов, превращаясь в высокоаффинные долгоживущие антителосекретирующие плазматические клетки, которые мигрируют в костный мозг, либо остаются в циркуляции в виде В-клеток памяти.
Предыдущие исследования раненого и долговременного В-клеточного иммунитета после перенесенной коронавирусной инфекции (COVID-19), показали, что количество спайк-специфических IgG+ В-клеток памяти сохраняется или даже растет в течение 6-12 месяцев после заболевания. Анализ моноклональных антител, полученных от этих В-клеток памяти, указывает на то, что в течение данного времени В-клетки памяти продолжают эволюционировать (что подтверждается высоким уровнем соматических гипермутаций), улучшая аффинность и нейтрализующую способность секретируемых антител.
В последние годы были открыты несколько новых подтипов активированных В-клеток и В-клеток памяти [1]. Так, были идентифицированы двойные негативные В-клетки (DN), или атипичные В-клетки памяти, которые не экспрессируют на своей поверхности иммуноглобулин D и маркер CD27. Размер данной популяции увеличивается с возрастом, а также составляет значимую часть В-клеточного звена у пациентов с хроническими инфекциями и аутоиммунными заболеваниями. В зависимости от экспрессии хемокинового рецептора CXCR5 DN В-клетки разделяют на 2 субпопуляции: DN1 (CXCR5+) и DN2 (CXCR5-). Кроме того, подтип DN1 В-клеток характеризуется отсутствием маркеров CD11c и FсRL5. По транскрипционному профилю данная субпопуляция близка к В-клеткам памяти с «переключенным» фенотипом (прошедшим переключение секреции изотипов иммуноглобулинов на IgG и/или IgA).
Для DN2-субпопуляции (CXCR5-/CD21-) характерна экспрессия CD11c и FсRL5, а также фактора транскрипции T-bet. Считается, что данная субпопуляция берет начало от активированных наивных В-клеток и развивается по вне-фолликулярному пути. Некоторые исследователи выделяют дополнительную субпопуляцию DN3 В-клеток молекулярным фенотипом: CD11c-/FcRL5- и CXCR5-/CD21-. DN3 В-клетки развиваются вне зародышевых центров и, скорее всего, представляют собой предшественников DN2-субпопуляции.
Показано, что DN2-субпопуляция более широко представлена у лиц, страдающих аутоиммунными заболеваниями, и возможно, вносят вклад в секрецию ауто-антител. Кроме того, данная субпопуляция обнаруживается в большем количестве у пациентов с тяжелым течением COVID-19, когда в ходе иммунного ответа наблюдается недостаточно активное образование новых зародышевых центров. Однако показано, что после выздоровления различие в соотношениях DN-субпопуляций у больных тяжелой и не тяжелой формами COVID-19 пропадало.
В работе [2] Raphael A. Reyes с коллегами проводили оценку влияния тяжести протекания COVID-19 на состав формирующегося компартмента В-клеточной памяти. Оценку В-клеточного звена проводили в течение 5 месяцев после перенесенного заболевания. Используя мультипараметрическую спектральную проточную цитометрию, авторы исследовали фенотип В-клеток памяти, специфичных к S-белку SARS-CoV-2 или к RBD-домену S-белка. 16 пациентов, принявших участие в исследовании, были разделены на 2 группы: в первую группу вошли лица с тяжелым течением COVID-19 (те, которым требовалась инвазивная механическая вентиляция легких или экстракорпоральная мембранная оксигенация), остальные пациенты составили группу нетяжелого течения заболевания.
Через месяц после выздоровления в крови пациентов обеих групп были обнаружены спайк-специфические IgG+ В-клетки, состоящие преимущественно из В-клеток памяти, а также небольшая фракция DN1 В-клеток. Независимо от тяжести заболевания в обеих группах спайк-специфические IgG+ В-клетки отличались более высокой экспрессией активационных маркеров: CD80, Ki-67 и CD95. Однако, в группе пациентов с нетяжелым течением COVID-19 спайк-специфические IgG+ В-клетки отличались более высоким уровнем экспрессии T-bet (28% против 10%). Известно, что клетки, экспрессирующие транскрипционный фактор T-bet, имеют особый молекулярный фенотип, включая присутствие на поверхности CD11c и FсRL5 и отсутствие CD21. В данном исследовании также было показано, что процент FсRL5+ спайк-специфических IgG+ В-клеток был выше в группе пациентов с нетяжелым течением заболевания. Экспрессия CD11c и CD21 на спайк-специфических IgG+ В-клетках статистически не различалась между двумя исследуемыми группами. При сравнении экспрессии CD11c, CD21и FсRL5 на всех IgG+ В-клетках между двумя группами было выявлено лишь небольшое увеличение FсRL5+ В-клеток в группе нетяжелого течения COVID-19. Важно, что повышение экспрессии FсRL5 было более выражено именно в субпопуляции спайк-специфических IgG+ В-клеток, а не во всей популяции IgG+ В-клеток.
Совокупный анализ экспрессии FcRL5, CD11c, CD21, CD27, CXCR3, и CXCR5 на спайк-специфических T-bet+ IgG+ В-клетках позволил ученым выделить 4 субпопуляции клеток, среди которых наиболее многочисленной вне зависимости от степени тяжести заболевания оказалась субпопуляция с молекулярным фенотипом: FcRL5+ CD11c+ CD27+ CXCR3+ CD21- CXCR5-. Такой фенотип В-клеток ранее был обнаружен у лиц после вакцинации от вируса гриппа. Присутствие данной субпопуляции, как правило, ассоциируют с развитием длительного гуморального иммунитета. В целом можно сказать, что преобладание в второй группе спайк-специфических IgG+ В-клеток, экспрессирующих маркеры, характерные для клеток, обеспечивающих долговременный иммунитет, говорит о том, что тяжесть заболевания оказывает влияние на качество В-клеточного иммунного ответа.
В более ранних исследования, посвященных оценке динамики В-клеточного иммунитета после COVID-19 было показано, что В-клетки памяти продолжают созревать на протяжении года после перенесенной инфекции [3]. В начале течения, как правило, в крови больных содержится большой процент В-клеток, не обладающих специфичностью к RBD-домену. По всей видимости, такие клетки берут начало от предсуществующих В-клеток памяти, обладающих кросс-реактивностью с другими коронавирусами. В эксперименте Raphael A. Reyes усиление аффинности секретируемых спайк-специфическими В-клетками антител к RBD-последовательности и их нейтрализующей способности происходило в интервале от 2-3 до 4-5 недель после возникновения первых симптомов и не претерпевало изменений при анализе В-клеток памяти спустя 5 месяцев.
Кроме того, различия в пропорции спайк-специфических В-клеток памяти между двумя группами пациентов также нивелировалось. Экспрессия T-bet была максимальной через 2-3 недели после начала заболевания, а затем падала до исходного уровня независимо от исследуемой группы пациентов. Большинство спайк-специфических В-клеток памяти имели фенотип покоящихся клеток (снижалась экспрессия CD80, Ki-67 и CD95) и их количество падало до исходного уровня. И только число спайк-специфических В-клеток с переключенным фенотипом (IgG+) находилось несколько выше базовой линии спустя 20-23 недели после начала проявления симптомов. В целом можно сказать, что значимое увеличение спайк-специфических T-bet+ В-клеток в периферической крови может быть маркером недавнего контакте индивидуума с вирусным антигеном.
- Sachinidis A, Garyfallos A. Double Negative (DN) B cells: A connecting bridge between rheumatic diseases and COVID-19?. Mediterr J Rheumatol. 2021;32(3):192-199. Published 2021 Sep 30. doi:10.31138/mjr.32.3.192
- Reyes RA, Clarke K, Gonzales SJ, Cantwell AM, Garza R, Catano G, Tragus RE, Patterson TF, Bol S, Bunnik EM. SARS-CoV-2 spike-specific memory B cells express higher levels of T-bet and FcRL5 after non-severe COVID-19 as compared to severe disease. PLoS One. 2021 Dec 22;16(12):e0261656. doi: 10.1371/journal.pone.0261656. PMID: 34936684; PMCID: PMC8694470.
- Sokal A, Chappert P, Barba-Spaeth G, Roeser A, Fourati S, Azzaoui I, et al. Maturation and persistence of the anti-SARS-CoV-2 memory B cell response. Cell. 2021; 184(5):1201–13. https://doi.org/10.1016/j.cell.2021.01.050 PMID: 33571429
Несмотря на множество общих характеристик, иммунитет, сформированный в результате перенесенной SARS-CoV-2-инфекции, отличается от такового после вакцинации, в первую очередь, тем, что он не ограничивается специфичностью к S-белку коронавируса. В практическом смысле данные различия могут отражаться в выраженности иммунного ответа организма в случае повторного столкновения с патогеном (ре-инфекции).
Первые различия между вакцино-индуцированным и естественно-сформированным иммунитетом появляются еще на уровне формирования плазмобластов. Острая фаза COVID-19 характеризуется массивной экспансией плазмобластов, тогда как вакцинация ведет к их более слабой продукции. Однако в дальнейшем вакцинация приводит к формированию уровня антител, достаточному для обеспечения надежной и долговременной защиты.
Тем не менее, функциональные характеристики антител после перенесенной инфекции и вакцинации остаются различными. Большинство исследований показывает, что как правило, большей специфичностью по отношению к S-белку (в частности, к RBD-последовательности) обладают антитела, сформированные в результате вакцинации, тогда как вирус-нейтрализующая активность выше у антител, образовавшихся после перенесенной инфекции.
Состав вакцины также оказывает влияние на профиль иммунной защиты организма. Более того, на качество иммунного ответа также влияет тяжесть перенесенного заболевания. Совокупное воздействие описанных факторов усложняет проведение адекватного сравнительного анализа иммунитета после вакцинации и перенесенной инфекции. Результаты посвященных этому исследований весьма противоречивы. Кроме того, в большинстве работ оценка гуморального звена иммунитета против SARS-CoV-2 сводится к измерению уровня антител против S-белка или RBD-последовательности, и характеристике их функциональной активности (вирус-нейтрализующая активность), а исследование В-клеточного иммунитета ограничивается определением количества S- и RBD- специфичных В-клеток памяти. При этом остается упущенной из вида оценка функциональной активности антител, секретируемых плазматическими клетками, полученными от ре-активированных В-клеток памяти в результате повторного столкновения с SARS-CoV-2.
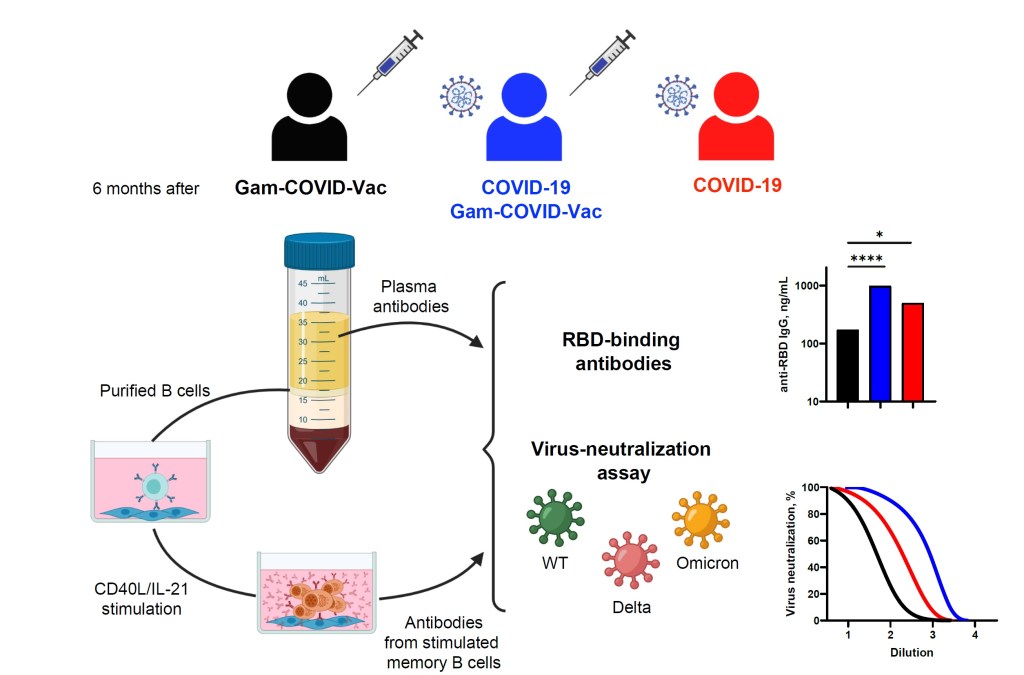
В нашем исследовании https://www.mdpi.com/2073-4409/11/13/1991#cite проводится оценка данной функциональной характеристики. Такая оценка позволяет учесть вклад происходящего с течением времени после инфекции/вакцинации созревания аффинности антител, продуцируемых ре-активированными В-клетками памяти.
Также уникальность нашей работы в том, что сравнение функционального потенциала В-клеток памяти, сформированных в результате вакцинации и вследствие заражения SARS-CoV-2, проводилось с использованием единой аналитической платформы.
Кроме того, используемая в исследовании вакцина – Gam-COVID-Vac– в отличие от большинства существующих на данный момент вакцин содержит в своем составе SARS-CoV-2 S-белок в нативной форме, что позволило провести корректный сравнительный анализ.
Все добровольцы, принявшие участие в исследовании, были разделены на 3 группы:
- не перенесшие SARS-CoV-2, провакцинированные Спутником (2 дозами) (N/V)
- ранее инфицированные SARS-CoV-2, провакцинированные Спутником (2 дозами) (PI/V)
- ранее инфицированные SARS-CoV-2, не получавших вакцинацию (PI/unV).
Промежуток времени между получением первой дозы вакцины/выздоровлением после SARS-CoV-2 и забором образцов крови составил около 6 месяцев.
В задачи нашей работы входило определение и оценка:
- Концентрации RBD-специфичных антител в сыворотке
- Концентрации вирус-нейтрализующих антител
- Количества RBD-специфичных В-клеток памяти, циркулирующих в периферическом кровотоке
- Количества АСК (антитело-секретирующих клеток), полученных от RBD-специфичных В-клеток памяти
- Активности антител, полученных от этих клеток, с помощью измерения:
— способности связываться с вирусной последовательностью RBD
— вирус-нейтрализующей способности.
Для реализации поставленных задач применялись 4 основных аналитических подхода:
- Проточная цитометрия RBD-специфичных клеток
- ELISpot – анализ количества SARS-CoV-2-специфичных АСК
- ELISA для количественного определения общего уровня антител, полученных от RBD-специфичных В-клеток памяти
- Оценка вирус-нейтрализующей способности антител, полученных от RBD-специфичных В-клеток памяти.
В результате проведенных экспериментов были получены следующие результаты:
- При помощи ELISA определены уровни IgG антител в сыворотке 3 групп через 6 месяцев после инфекции/вакцинации.
Показано, что концентрация IgG анти-RBD в сыворотке в группах, перенесших SARS-CoV-2, была значимо выше, чем в группе вакцинированных добровольцев, не болевших SARS-CoV-2.
- С использованием псевдотипированного (лентивирусные частицы псевдотипированные диким SARS—CoV-2, штаммами дельта и омикрон) коронавируса проведена оценка вирус-нейтрализующей способности данных антител (циркулирующих в плазме).
Вирус-нейтрализующая способность плазмы была существенно выше в группах, перенесших SARS-CoV-2, по сравнению со здоровыми вакцинированными добровольцами. Также наблюдалось сильное ослабление вирус-нейтрализующей способности плазмы во всех трех группах против штаммов дельта- (примерно в 3 раза) и омикрон- (в 10, 8 и 18 раз для групп N/V, PI/V и PI/unV соответственно) по сравнению с таковой для дикого типа.
- Количественное определение В-клеток памяти проводили при помощи 2 комплементарных методов: проточной цитометрии и ELISpot. Основываясь на способности В-клеток памяти связывать флуоресцентно-меченный RBD, последние определяли с помощью проточной цитометрии (по фенотипу CD19+CD27+IgD-). Для подтверждения полученных результатов проводили ELISpot-анализ антитело-секретирующих клеток, полученных в результате in vitro поликлональной стимуляции (CD40L/IL-21) выделенных В-клеток памяти.
Было показано, что в группах PI/V и PI/unV количество RBD-специфичных В-клеток памяти было примерно в 3 раза выше, чем в группе не перенесших SARS-CoV-2 вакцинированных добровольцев (группа N/V). Что касается антител-секретирующих клеток, полученных после in vitro-стимуляции В-клеток памяти, то они были обнаружены у 60% (9/15), 100% (13/13) и 96% (25/26) добровольцев из групп N/V, PI/V и PI/unV соответственно. Статистически значимые различия были зарегистрированы между группами N/V и PI/V, и PI/V и PI/unV. Однако, необходимо отметить, что через 6 месяцев в образцах крови всех добровольцев количества антител-секретирующих клеток были значительно ниже таковых, взятых от пациентов в ходе острой фазы заболевания или на 85 день после вакцинации (согласно литературным данным).
4) Антитела, продуцируемые антитело-секретирующими клетками, полученными в результате поликлональной стимуляции CD40L/IL-21 В-клеток памяти, были оценены с количественной точки зрения (при помощи ELISA измерены уровни IgG, IgA и IgM антител против RBD-последовательности SARS—CoV-2 у 3 групп). Функциональные характеристики данных антител оценивались при помощи определения их вирус-нейтрализующей способности в тесте с псевдотипированным вирусом (SARS—CoV-2 дикого типа, штаммами дельта и омикрон).
Наибольшее количество добровольцев с высоким уровнем RBD-специфичных IgG составляли группу PI/unV. Самые низкие уровни RBD-специфичных антител класса G были у не болевших SARS-CoV-2 добровольцев (группа N/V). Далее при помощи псевдотипированных S-белком (от SARS-CoV-2 дикого типа, штаммов дельта и омикрон -) лентивирусных частиц был проведен анализ вирус-нейтрализующей способности антител, полученных от стимулированных in vitro В-клеток памяти. Результаты эксперимента показали, что вирус-нейтрализующая способность в супернатантах, полученных от добровольцев группы PI/unV, оказалась приблизительно в 2 раза выше, чем в группе N/V. Интересно, что была выявлена слабая корреляция между концентрациями RBD-специфичных IgG, полученных после in vitro – стимуляции В-клеток памяти, и вирус-нейтрализующей способностью супернатантов.
В отношении исследуемых штаммов SARS-CoV-2 было показано, что супернатанты у всех исследуемых групп проявляли самую высокую нейтрализующую способность против дикого типа вируса и самую низкую – против штамма омикрон.
В целом, проведенное нами исследование позволяет сделать вывод, что в результате перенесенного SARS-CoV-2, иммунитет, опосредованный В-клетками памяти, обеспечивает более длительную и надежную защиту нежели таковой, сформированный благодаря вакцинации. Тем не менее, необходимо иметь ввиду, что вакцинация несет гораздо меньше рисков и имеет более предсказуемые последствия для организма по сравнению с вирусным заболеванием. Наши данные могут быть полезны для оценки необходимости и сроков ревакцинации.
Векторные вакцины — это вакцины, в которых для доставки требуемого антигена в клетки человека используются генетически модифицированные вирусные частицы-носители.
Иммунизация векторными вакцинами ведет к выработке антител не только к целевому компоненту, но и к самому вектору. В случае с вакцинами от COVID-19 на основе аденовирусных векторов график вакцинации предполагает первичную вакцинацию, состоящую из двух этапов (на первом этапе вводится компонент №1, основанный на рекомбинантном аденовирусном векторе rAd-26, через 21 день используется второй компонент, содержащий в своем составе вектор rAd-5), а также ревакцинацию через некоторое время для усиления имеющегося иммунного ответа на уровне, достаточном для защиты от новых штаммов SARS-CoV 2. В качестве бустерной вакцины для ревакцинации используется рекомбинантный аденовирусный вектор, идентичный таковому в первом компоненте вакцины (rAd-26). Из этого вытекает опасение, что повторное введение вирусного вектора усилит выработку нейтрализующих антител к нему, тем самым снизит эффективность бустерной вакцины в отношении SARS-CoV 2.
В нашем исследовании мы попытались выяснить, влияют ли антитела против rAd-26 на силу гуморального иммунного ответа против SARS-CoV 2. Для этого проводилось измерение уровня нейтрализующих антител против rAd-26, rAd-5, SARS-CoV 2, а также IgG против RBD-последовательности спайк-белка SARS-CoV 2 в течение 14 месяцев после первичной вакцинации (бустерная вакцина вводилась через 9 месяцев после основной). В исследовании было включено 58 добровольцев. В основной группе в качестве бустера использовалась вакцина на основе rAd-26, а в группе сравнения бустером служила мРНК-вакцина от Pfizer (Pfizer-BioNTech’s Comirnaty). Оценка уровня специфических антител против векторного компонента проводилась при помощи вирус-нейтрализующего метода с последующей цитометрией.
В результате было показано, что несмотря то, что вектор-нейтрализующие антитела сохранялись на достаточно высоком уровне к моменту бустерной вакцинации (на 9 месяц после первичной вакцинации) это не оказывало влияние на титры антител против SARS-CoV 2, а, следовательно не уменьшало силу гуморального ответа, формирующегося в результате ревакцинации.
Самым очевидным объяснением полученных результатов может быть то, количество векторных частиц, введенных в вакцину, значительно превышает количество предсуществующих нейтрализующих антител в сыворотке, поэтому их влияние на противовирусный иммунитет незначительно.
Кроме того, существует мнение, что антитела против векторного компонента могут даже стимулировать иммунный ответ через механизм Fc-рецептор-опосредованного внедрения вируса. Данный механизм лежит в основе описанного ранее явления антитело-зависимого усиления инфекции. Связывание субнейтрализующих антител с компонентами вакцины может усиливать слияние вирусных частиц с иммунными клетками посредством взаимодействия с Fc-рецепторами, экспрессирующимися на ее поверхности, что в конечном итоге приводит к активации Т- и В-лимфоцитов и увеличению титра антител против SARS-CoV 2.
Наблюдаемое отрицательного влияния вектор-нейтрализующих антител на уровень SARS-CoV 2-нейтрализующих антител может быть результатом взаимной компенсации 2 противоположных эффектов:
1) антитело-зависимого усиления инфекции, приводящего к росту титра SARS-CoV 2-специфических антител и
2) антитело-зависимой нейтрализации вирусных частиц, обусловленной наличием предсуществующих антител против векторного компонента вакцины, вызывающих уменьшение концентрации свободных вирусных частиц и, как следствие, титра SARS-CoV 2-специфических антител.
Показанное в данном исследования отсутствие ассоциации между наличием нейтрализующих антител к векторному компоненту вакцины и гуморальным иммунным ответом к SARS-CoV позволяет сделать вывод о возможности проводить эффективную ревакцинацию бустерной вакциной в сроки, определяемые врачом клиницистом в конкретном случае. Тем не менее, изучение возможных изменений в Т-клеточном иммунном ответе, возникающих на введение бустерной вакцины, требует дальнейших исследований.
Полученные нами результаты релевантны не только для вакцины «Спутник -V», они также могут быть экстраполированы на другие векторные вакцины, например, на рекомбинантную вакцину ChAdOx1-S/nCoV-1 от AstraZeneca.

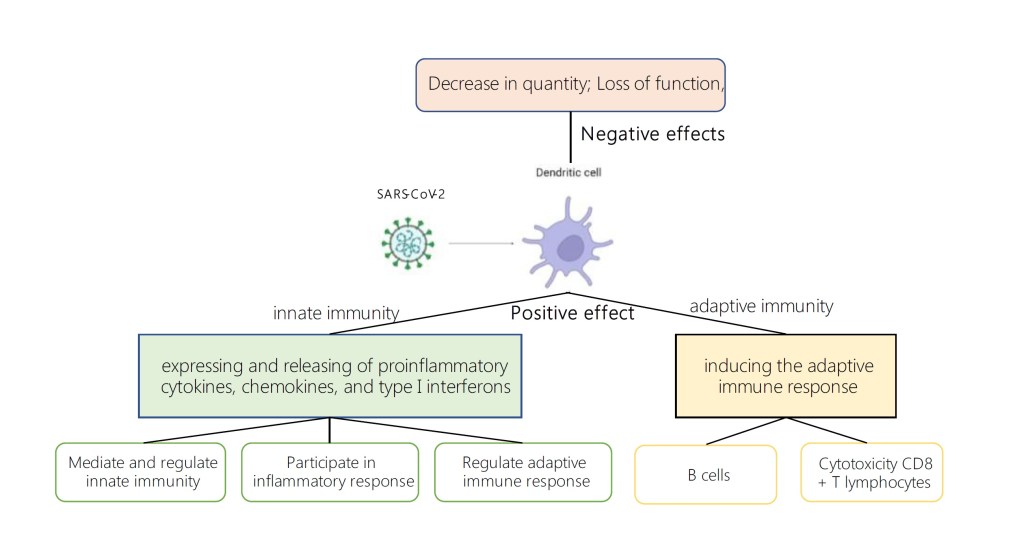
Дендритные клетки (ДК), являясь своеобразным «мостиком», соединяющим врожденный и адаптивный иммунитет, играют важную роль в сопротивлении организма вирусным заболеваниям. В нашем обзоре описаны возможные механизмы, с помощью которых ДК участвуют в заражении вирусом SARS-CoV-2, а также рассмотрена связь между клиническим прогрессированием заболевания и функциональным состоянием ДК.
Процесс проникновения вируса SARS-CoV-2 в клетку происходит при помощи спайк-белка вирусной оболочки. Известно, что SARS-CoV-2 в основном поражает клетки дыхательных путей человека при помощи взаимодействия RBD-домена S1-субъединицы спайк-белка с рецептором АСЕ-2 на клетках легкого, при этом S2-субъединица служит для обеспечения слияния мембран вируса и клетки-хозяина. В процессе слияния также участвует трансмембранная сериновая протеаза TMPRSS2, разрезающая сайт S1/S2. Кроме того, S-белок может быть расщеплен при помощи катепсина -L, опосредующего эндосомальный путь слияния мембран. Показано, что на поверхности легочных интестициональных ДК экспрессируется АСЕ-2, следовательно, ДК могут быть инфицированы SARS-CoV-2. Также вероятность заражения ДК SARS-CoV-2 повышается при взаимодействии вируса с другими клеточными рецепторами, тоже способствующими его проникновению: DPP-4, DC-SING, CD147. Экспрессия перечисленных рецепторов на ДК также описана в литературе. [1,2,3,4]
Кроме того, в исследовании [5] было показано, что ДК и клетки Лангерганса слизистой оболочки, даже не будучи инфицированы SARS-CoV-2, способны эффективно захватывать SARS-CoV-2 через поверхностные гепарансульфатные протеогликаны и передавать вирус в ACE2-положительные клетки.
Роль ДК в COVID-19
ДК берут свое начало от CD34+ стволовых клеток костного мозга. Наивные ДК располагаются преимущественно в коже и на поверхности слизистых оболочек. При столкновении с антигенами (DAMPs — дистресс-ассоциированные молекулярные паттерны, PAMPs — патоген-ассоциированный молекулярные фрагменты молекул) происходит процесс созревания ДК, в ходе которого они распознают, процессируют и презентируют антиген иммунным клеткам. В процессе созревания ДК мигрируют в лимфоидные ткани, при этом их способность к эндоцитозу падает, в то время как способность к продукции иммуностимуляторных цитокинов растет. Также на поверхности ДК растет количество рецепторов MHC и костимуляторных молекул. Показано, что спайк-белок коронавируса, а точнее, его RBD-домен способен увеличивать количество молекул MHCI и MHCII на поверхности ДК, а также усиливать экспрессию костимуляторных молекул CD40, CD80 и CD86. Это говорит о том, что запускается процесс активации ДК, а следовательно, можно сделать вывод, что ДК способны распознавать S-белок SARS-CoV-2.
В ткани легкого присутствуют 3 типа ДК: «конвенциональные ДК» (кДК ) 1 и 2 типов, происходящие от миелоидных предшественников, а также плазмацитоидные ДК. кДК 1 типа локализуются преимущественно в сосудистой стенке легкого и в слизистых оболочках. кДК1 экспрессируют на поверхности CD141 и отличаются высокой способностью к кросс-презентации антигенов. кДК1 стимулируют Th1-CD8+ T- лимфоциты, а также NK-клетки.
кДК2 локализованы в подслизистой оболочке. Данные клетки характеризуются экспрессией CD1, а также повышенной плотностью патогенраспознающих рецепторов на поверхности. кДК2 продуцируют провоспалительные хемокины и стимулируют CD4+ Т-лимфоциты, участвуют в агрегации провоспалительных клеток в очаге инфекции. Кроме того, показано, что кДК2 могут принимать участие в процессе формирования иммунной толерантности.
Другая субпопуляция ДК – пДК — образуются от клетки-предшественницы лимфопоэза. Данные клетки располагаются в паренхиме и строме легкого, а также в воздухоносных путях. У пДК обнаружена экспрессия толл-подобных рецеторов 7, 9, распознающих эндосомальные нуклеиновые кислоты. На связывание упомянутых рецепторов пДК отвечают высокой продукцией IFN-I, III, TNF-a, а также ряда хемокинов, стимуляируя при этом клетки врожденного звена иммунитета.
В ходе воспалительного процесса ДК также могут продуцироваться циркулирующими моноцитами. Такие ДК выделяют в отдельную субпопуляцию — моДК.
Зрелые ДК активируют как клетки врожденного (моноциты, макрофаги, натуральные киллеры), так и адаптивного иммунитета (Т- и В-лимфоциты).
Роль ДК во врожденном иммунитете
РНК-геном коронавируса распознается РНК-сенсорами, расположенными в цитоплазме и эндосомах (RIG-1, TLRs), которые активируют фактор регуляции интерферона-3 (IFR-3), а также ядерный фактор NF-KB. IFR-3 иNF-KB стимулируют транскрипцию провоспалительных генов, что выражается в продукции провоспалительных цитокинов, хемокинов и интерферонов 1 типа, которые способны как напрямую ингибировать репликацию вируса, так и активировать различные иммунокомпетентные клетки.
Благодаря высокой выработке IFN-I пДК отводится важнейшая роль в противовирусном иммунном ответе.
Уровень IFN-α тесно связан со степенью поражения органов при вирусной инфекции, его количество повышается пропорционально степени тяжести заболевания. Однако показано, что у пациентов в острой фазе SARS-COV-2-инфекции снижается количество ДК и уменьшается TLR9-зависимая продукция IFN-α. [6]
Интересно, что, в отличие от других респираторных вирусов, SARS-COV-2 вызывает более низкую продукцию организмом IFN-I. Возможно, ДК являются единственным источником IFN-I при COVID-19.
Роль ДК в адаптивном иммунитете
In vivo ДК обладают уникальной способностью фагоцитировать патоген, не будучи сами инфицированы. После фагоцитоза ДК способны презентировать антиген лимфоцитам, при этом происходит созревание ДК. В процессе созревания ДК конститутивно экспрессируют рецепторы MHCII и костимуляторные молекулы, а также отличаются выраженной способностью к миграции, что делает их основными «профессиональными» антигенпрезентирующими клетками, способными активировать Т- и В-клеточное звено врожденного иммунитета.
В зависимости от происхождения антигена его презентация ДК происходит по двум путям. Если антиген имеет экзогенную природу (например, антиген патогена), то он презентируется в составе молекул MHC-II. Так, «мертвые» вирусы захватываются ДК, попадают в эндосомы и затем презентируются CD4+ Т-лимфоцитам с помощью MHC-II.
Аутоантигены презентируются на клеточной поверхности в комплексе с молекулами MHC-I, активируя при этом CD8+ Т-лимфоциты. При инфицировании ДК вирусом, его геном попадает в ядро, запускается процесс синтеза вирусных белков, которые убиквитинилируются, расщепляются в протеосомах на фрагменты и начинают экспрессироваться на поверхности клеток, также как и аутоантигены, в составе MHC-I.
Кроме того, пДК способны к кросс-презентации антигена, в ходе которой молекулы MHC-I презентируют внеклеточные антигены, которые обычно презентируются MHC-II. Чаще всего, кросс-презентация происходит тогда, когда антигенпрезентирующая клетка не инфицирована сама, но запускает локальный противовирусный иммунный ответ.
ДК также способны запускать В-клеточное звено адаптивного иммунитета. Показано, что активированные вирусом пДК, вырабатывая повышенное количество IFN-α, индуцируют дифференциацию В-лимфоцитов в плазматические клетки. [7]
Исследования показали, что, несмотря на то, что SARS-COV-2 может реплицироваться внутри ДК, последующего увеличения вирусной РНК не наблюдается. Вероятно, происходит обрыв вирусной репликации и ДК не продуцируют вирулентные вирусы. Также показано, что в зараженных ДК не происходит индукции генов, запускающих апоптоз, но одновременно с этим тормозится экспрессия генов, отвечающих за процесс созревания.
Клинические данные демонстрируют снижение процента ДК у пациентов в острой фазе COVID-19, а также у реконвалесцентов, что говорит о возможном цитопатическом действии SARS-COV-2 на ДК. Кроме того, было показано, что при SARS-COV-2-инфекции:
1) CD1c+ кДК вырабатывают меньше IFN-α, β и γ. Снижение выработки противовирусных цитокинов можно рассматривать как результат уклонения вируса от иммунного ответа.
2) ухудшается экспрессия ДК костимуляторных молекул CD80/86, что приводит к недостаточной активации Т-клеток. Возможно, именно этот механизм лежит в основе отсроченного иммунного ответа, часто наблюдаемого в ходе SARS-COV-2-инфекции.
3) в ДК падает экспрессия HLA-DR, а следовательно, снижается способность к эффективной презентации антигена.
4) инфицированные моДК экспрессируют провоспалительные цитокины и хемокины на повышенном уровне, что усиливает остроту проявления воспалительной реакции. Одновременно с этим наблюдается снижение продукции противовирусных интерферонов (IFN-α иβ). Такой молекулярный профиль реакции на SARS-COV-2-инфекцию может объяснить наблюдаемую повышенную активацию врожденного звена иммунитета в острой фазе заболевания.
Таким образом, можно сделать вывод, что при заражении ДК SARS-COV-2 избегает механизмы иммунной защиты за счет снижения общего числа ДК, уменьшения их функциональных возможностей (в частности, посредством снижения их способности к продукции IFN).
Нарушения в работе ДК влияют на клинические проявления, исход заболевания и вероятность повторной инфекции. Так, снижение функционирования ДК приводит к недостаточному формированию иммунологической памяти после перенесенного заболевания, а также к ослаблению защитного действия вакцин. Поэтому увеличение количества и качества ДК представляется важной терапевтической задачей. На данный момент рассматриваются стратегии модуляции созревания ДК через мезенхимальные стволовые клетки. [8]
1. Lan, J., et al., Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor. Nature, 2020. 581(7807): p. 215-220.
2. Brufsky, A. and M.T. Lotze, DC/L-SIGNs of hope in the COVID-19 pandemic. J Med Virol, 2020. 92(9): p. 1396-1398.
3. Soilleux, E.J., et al., Constitutive and induced expression of DC-SIGN on dendritic cell and macrophage subpopulations in situ and in vitro. J Leukoc Biol, 2002. 71(3): p. 445-57.
4. Wang, K., et al., CD147-spike protein is a novel route for SARS-CoV-2 infection to host cells. SignalTransductTargetTher, 2020. 5(1): p. 283.
5. Bermejo-Jambrina, M., et al., Infection and transmission of SARS-CoV-2 depend on heparansulfate proteoglycans. EMBO J, 2021. 40(20): p. e106765.
6. Perez-Gomez, A., et al., Dendritic cell deficiencies persist seven months after SARS-CoV-2 infection. CellMolImmunol, 2021. 18(9): p. 2128-2139.
7. Jego, G., et al., Plasmacytoid dendritic cells induce plasma cell differentiation through type I interferon and interleukin 6. Immunity, 2003. 19(2): p. 225-34. 8. Mallis, P., et al., Mesenchymal stromal cells as potential immunomodulatory players in severe acute respiratory distress syndrome induced by SARS-CoV-2 infection. World J Stem Cells, 2020. 12(8): p. 731-751.